tabla de los elementos
De Wikipedia, la enciclopedia libre
La tabla periódica de los elementos clasifichbfhgsfbdvahsfVBJKBVAFANBhJVNFK y distribuye los distintos elementos químicos, conforme a sus propiedades y características.Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev, fue diseñada por Alfred Werner.
[editar] Historia
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:- El descubrimiento de los elementos de la tabla periódica
- El estudio de las propiedades comunes y la clasificación de los elementos
- La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
[editar] El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.[editar] La noción de elemento y las propiedades periódicas
Lógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes 2 siglos, se fue adquiriendo un gran conocimiento sobre estas propiedades, así como descubriendo muchos nuevos elementos.La palabra "elemento" procede de la ciencia griega pero su noción moderna apareció a lo largo del siglo XVII, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra "The Sceptical Chymist", donde denomina elementos "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo XVIII, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra "Tratado elemental de Química". Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
[editar] Los pesos atómicos
A principios del siglo XIX, John Dalton (1766–1844) desarrolló una nueva concepción del atomismo, al que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un "atomismo químico" que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743–1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo cómo se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton conocía que 1 parte de hidrógeno se combinaba con 7 partes (8 afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos como los llamaba Dalton) que fue posteriormente modificada y desarrollada en los años posteriores. Las incertidumbres antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos que sólo comenzarían a superarse, aunque no totalmente, con el congreso de Karlsruhe en 1860.
[editar] Metales, no metales, metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.[editar] Tríadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner (1780–1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).| Litio | LiCl LiOH | Calcio | CaCl2 CaSO4 | Azufre | H2S SO2 | ||||||
| Sodio | NaCl NaOH | Estroncio | SrCl2 SrSO4 | Selenio | H2Se SeO2 | ||||||
| Potasio | KCl KOH | Bario | BaCl2 BaSO4 | Telurio | H2Te TeO2 |
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las tríadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la tríada Cloro, Bromo, Yodo los pesos atómicos son respectivamente 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atómico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de tríadas.
[editar] Chancourtois
En 1864, Chancourtois construyó una hélice de papel, en la que estaban ordenados por pesos atómicos (masa atómica) los elementos conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma generatriz, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.[editar] Ley de las octavas de Newlands
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 | Be 9,0 Mg 24,3 Ca 40,0 | B 10,8 Al 27,0 | C 12,0 Si 28,1 | N 14,0 P 31,0 | O 16,0 S 32,1 | F 19,0 Cl 35,5 |
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
[editar] Tabla periódica de Mendeléyev
En 1869, el ruso Dmitri Ivánovich Mendeléyev publicó su primera Tabla Periódica en Alemania. Un año después lo hizo Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
- Colocaron los elementos por orden creciente de sus masas atómicas.
- Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléyev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka–aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka–sicilio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
[editar] La noción de número atómico y la mecánica cuántica
La tabla periódica de Mendeléyev presentaba ciertas irregularidades y problemas. En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las "tierras raras" y los elementos radioactivos. Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio–yodo, argón–potasio y cobalto–níquel, en las que se hace necesario alterar el criterio de pesos atómicos crecientes en favor de la agrupación en familias con propiedades químicas semejantes.Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867–1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de cargas positivas del núcleo.
La explicación que aceptamos actualmente de la "ley periódica" descubierta por los químicos de mediados del siglo pasado surgió tras los desarrollos teóricos producidos en el primer tercio del siglo XX. En el primer tercio del siglo XX se construyó la mecánica cuántica. Gracias a estas investigaciones y a los desarrollos posteriores, hoy se acepta que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades químicas.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Periodo | ||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo |
| Lantánidos | * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |
| Actínidos | ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |
[editar] Clasificación
[editar] Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (y entre paréntesis según la antigua propuesta de la IUPAC) de 1988[2] , los grupos de la tabla periódica son:
- Grupo 1 (I A): los metales alcalinos
- Grupo 2 (II A): los metales alcalinotérreos
- Grupo 3 (III B): Familia del Escandio
- Grupo 4 (IV B): Familia del Titanio
- Grupo 5 (V B): Familia del Vanadio
- Grupo 6 (VI B): Familia del Cromo
- Grupo 7 (VII B): Familia del Manganeso
- Grupo 8 (VIII B): Familia del Hierro
- Grupo 9 (VIII B): Familia del Cobalto
- Grupo 10 (VIII B): Familia del Níquel
- Grupo 11 (I B): Familia del Cobre
- Grupo 12 (II B): Familia del Zinc
- Grupo 13 (III A): los térreos
- Grupo 14 (IV A): los carbonoideos
- Grupo 15 (V A): los nitrogenoideos
- Grupo 16 (VI A): los calcógenos o anfígenos
- Grupo 17 (VII A): los halógenos
- Grupo 18 (VIII A): los gases nobles
[editar] Períodos
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.La tabla periódica consta de 7 períodos:
La tabla también está dividida en cuatro grupos, s, p, d, f, que están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la letra en terminación de los elementos de este grupo, según el principio de Aufbau.
[editar] Bloques o regiones

Tabla periódica dividida en bloques.
Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
[editar] Otras formas de representar la tabla periódica
- Varias formas (en espiral, en 3D) [1];
- 1951. Forma en espiral, [2] ;
- 1960. Forma en espiral, profesor Theodor Benfey[3];
- 1995. Forma en espiral-fractal, Melinda E Green *[4];
- 2004, noviembre. Forma en espiral sobre dibujo de galaxia, Philip J. Stewart [5];
[editar] Véase también
- Tabla periódica de los elementos ampliada
- Tabla periódica de los elementos curvada
- Lista de elementos por símbolo
- Listado alfabético de elementos químicos
- La Tabla periódica de Dmitri Mendeléyev.
- Nomenclatura química de los compuestos inorgánicos (para consultar los números de valencia de los elementos)
[editar] Referencias
[editar] Bibliografía
- AGAFOSHIN, N.P., Ley periódica y sistema periódico de los elementos de Mendeleiev Madrid Editorial Reverté, 1977, 200 p.
- BENSAUDE-VICENT, B. D. Mendeleiev: El sistema periódico de los elementos, Mundo científico, (1984), 42, 184-189.
- MUÑOZ, R. y BERTOMEU SANCHEZ, J.R.La historia de la ciencia en los libros de texto: la(s) hipótesis de Avogadro, Enseñanza de las ciencias (2003), 21 (1), 147-161. Texto completo
- ROCKE, A.J. 1984 Chemical Atomism in the Nineteenth Century. From Dalton to Cannizzaro. Ohio. Ohio State University Press, 1984.
- ROMÁN POLO, P: El profeta del orden químico: Mendeléiev. Madrid: Nivola, 2002, 190 p
- SCERRI, E.R., "Evolución del sistema periódico" Investigación y Ciencia (1998), 266, p. 54-59.
- SCERRI, E.R., The Periodic Table: Its Story and Its Significance, Oxford, University Pres, 2006, 400 p.
- STRATHERN, PAUL (2000) , El sueño de Mendeléiev, de la alquimia a la química, Madrid : Siglo XXI de España Editores, 288 p.
De Wikipedia, la enciclopedia libre

Esquema del Sistema Solar que incluye los planetas y planetas enanos. Los tamaños se encuentran a escala, las distancias entre los planetas y la ubicación no, debido a que una reproducción a escala es imposible por las distancias entre sí.
Está formado por una única estrella llamada Sol, que da nombre a este Sistema, más ocho planetas que orbitan alrededor de la estrella: Mercurio, Venus, Tierra, Marte, Júpiter, Saturno, Urano y Neptuno; más un conjunto de otros cuerpos menores: planetas enanos (Plutón, Eris, Makemake, Haumea y Ceres), asteroides, satélites naturales, cometas... así como el espacio interplanetario comprendido entre ellos.
Contenido[ocultar] |
[editar] Características generales

El Sol.
- Sol. Una estrella de tipo espectral G2 que contiene más del 99% de la masa del sistema. Con un diámetro de 1.400.000 km, se compone, de un 75% de hidrógeno, un 20% de helio y el 5% de oxígeno, carbono, hierro y otros elementos.
- Planetas. Divididos en planetas interiores (también llamados terrestres o telúricos) y planetas exteriores o gigantes. Entre estos últimos Júpiter y Saturno se denominan gigantes gaseosos mientras que Urano y Neptuno suelen nombrarse como gigantes helados. Todos los planetas gigantes tienen a su alrededor anillos.
- Planetas enanos. Esta nueva categoría inferior a planeta la creó la Unión Astronómica Internacional en agosto de 2006. Se trata de cuerpos cuya masa les permite tener forma esférica, pero no es la suficiente para haber atraído o expulsado a todos los cuerpos a su alrededor. Cuerpos como Plutón (hasta 2006 considerado noveno planeta del Sistema Solar), Ceres, Makemake, Eris y Haumea están dentro de esta categoría.
- Satélites. Cuerpos mayores orbitando los planetas, algunos de gran tamaño, como la Luna, en la Tierra, Ganímedes, en Júpiter o Titán, en Saturno.
- Asteroides. Cuerpos menores concentrados mayoritariamente en el cinturón de asteroides entre las órbitas de Marte y Júpiter, y otra más allá de Neptuno. Su escasa masa no les permite tener forma regular.
- Objetos del cinturón de Kuiper. Objetos helados exteriores en órbitas estables, los mayores de los cuales serían Sedna y Quaoar.
- Cometas. Objetos helados pequeños provenientes de la Nube de Oort.
Los diferentes sistemas planetarios observados alrededor de otras estrellas parecen marcadamente diferentes al Sistema Solar, si bien existen problemas observacionales para detectar la presencia de planetas de baja masa en otras estrellas. Por lo tanto, no parece posible determinar hasta qué punto el Sistema Solar es característico o atípico entre los sistemas planetarios del Universo.
[editar] Estructura del Sistema Solar
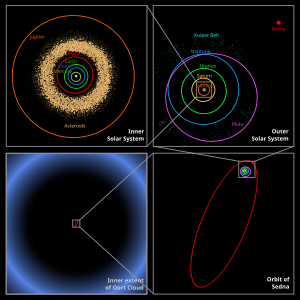
Arriba a la izquierda: 1) Sistema Solar interior: desde el Sol hasta el Cinturón de asteroides. 2) A la derecha: Sistema Solar exterior: desde Júpiter hasta el Cinturón de Kuiper. 3) Abajo a la derecha: la órbita del planeta menor Sedna en comparación con la imagen de la izquierda, la Nube de Oort, límite exterior del Sistema Solar.
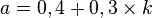 donde
donde  = 0, 1, 2, 4, 8, 16, 32, 64, 128.
= 0, 1, 2, 4, 8, 16, 32, 64, 128.
En esta formulación la órbita de Mercurio se corresponde con (k=0) y semieje mayor 0,4 UA, y la órbita de Marte (k=4) se encuentra en 1,6 UA. En realidad las órbitas se encuentran en 0,38 y 1,52 UA.Ceres, el mayor asteroide, se encuentra en la posición k=8. Esta ley no se ajusta a todos los planetas (Neptuno está mucho más cerca de lo que se predice por esta ley). Por el momento no hay ninguna explicación de la ley de Titius-Bode y muchos científicos consideran que se trata tan sólo de una coincidencia.
[editar] La dimensión astronómica de las distancias en el espacio
Para tener una noción de la dimensión astronómica de las distancias en el espacio, es interesante hacer un modelo a escala que permita tener una percepción más clara del mismo. Imagínese un modelo reducido en el que el Sol esté representado por una pelota de fútbol (de 220 mm de diámetro). A esa escala, la Tierra estaría a 23,6 m de distancia y sería una esfera con apenas 2 mm de diámetro (la Luna estaría a unos 5 cm de la tierra y tendría un diámetro de unos 0,5 mm) . Júpiter y Saturno serían bolitas con cerca de 2 cm de diámetro, a 123 y a 226 m del Sol respectivamente. Plutón estaría a 931 m del Sol, con cerca de 0,3 mm de diámetro. En cuanto la estrella más próxima (Próxima Centauri) estaría a 6.332 km del Sol, y la estrella Sirio a 13.150 km.Si se tardase 1 h y cuarto en ir de la Tierra a la Luna (a unos 257.000 km/h), se tardaría unas 3 semanas (terrestres) en ir de la Tierra al Sol, unos 3 meses en ir a Júpiter, 7 meses a Saturno y unos 2 años y medio en llegar a Plutón y dejar nuestro Sistema Solar. A partir de ahí, a esa velocidad, tendríamos que esperar unos 17.600 años hasta llegar a la estrella más próxima, y 35.000 años hasta llegar a Sirio.
Una escala comparativa más exacta puede ser si comparamos el Sol con un disco compacto de 12 cm de diámetro. A esta escala, la Tierra tendría poco más de medio milímetro de diámetro (0,55 mm). El Sol estaría a 6,44 metros. El diámetro de la estrella más grande del Universo conocido, VY Canis Majoris, sería de 264 metros (imaginemos esa enorme estrella de casi tres manzanas de casas de tamaño comparado con nuestra estrella de 12 cm). La órbita externa de Eris se alejaría a 625.48 metros del sol. Allí nos espera un gran vacío hasta la estrella más cercana ,Proxima Centauri, a 1645,6 Km de distancia. A partir de allí las distancias galácticas exceden el tamaño de la Tierra (aún hablando en la misma escala). Con nuestro Sol del tamaño de un Disco Compacto, el centro de la galaxia estaría a casi 11 millones de kilómetros y el diámetro de la Via Láctea sería de casi 39 millones de kilómetros. Un enorme vacío nos espera porque la galaxia Andrómeda estaría a 1028 millones de kilómetros, casi la distancia al Sol de Saturno.
[editar] Objetos principales del Sistema Solar
| | |
|---|---|
| Planetas y enanos | Sol - Mercurio - Venus - Tierra - Marte - Ceres - Júpiter - Saturno - Urano - Neptuno - Plutón - Haumea -Makemake - Eris |
| Satélite natural | Terrestre - Marcianas - Asteroidales - Jovianas - Saturnianas - Uranianas - Neptunianas - Plutonianas - Haumeanas - Eridiana |
[editar] Estrella central
El Sol es la estrella del sistema planetario en el que se encuentra la Tierra; por tanto, es la más cercana a la Tierra y el astro con mayor brillo aparente. Su presencia o su ausencia en el cielo determinan, respectivamente, el día y la noche. La energía radiada por el Sol es aprovechada por los seres fotosintéticos, que constituyen la base de la cadena trófica, siendo así la principal fuente de energía de la vida. También aporta la energía que mantiene en funcionamiento los procesos climáticos. El Sol es una estrella que se encuentra en la fase denominada secuencia principal, con un tipo espectral G2, que se formó hace unos 5000 millones de años y permanecerá en la secuencia principal aproximadamente otros 5000 millones de años. El Sol, junto con la Tierra y todos los cuerpos celestes que orbitan a su alrededor, forman el Sistema Solar.A pesar de ser una estrella mediana, es la única cuya forma se puede apreciar a simple vista, con un diámetro angular de 32' 35" de arco en el perihelio y 31' 31" en el afelio, lo que da un diámetro medio de 32' 03". Por una extraña coincidencia, la combinación de tamaños y distancias del Sol y la Luna respecto de la tierra son tales que se ven, aproximadamente, con el mismo tamaño aparente en el cielo. Esto permite una amplia gama de eclipses solares distintos (totales, anulares o parciales).
[editar] Planetas
El 24 de agosto de 2006, en Praga, en la XXVI Asamblea General la Unión Astronómica Internacional (UAI), se excluyó a Plutón como planeta del Sistema Solar. Tras una larga controversia sobre esta resolución, se tomó la decisión por unanimidad. Con esto se reconoce el error de haber otorgado la categoría de planeta a Plutón en 1930, año de su descubrimiento. Desde ese día el Sistema Solar queda compuesto por 8 planetas.Los 8 planetas que integran el Sistema Solar, de acuerdo con su cercanía al Sol, son: Mercurio, Venus, Tierra, Marte, Júpiter, Saturno, Urano y Neptuno. Y estos planetas son astros que giran de manera circular formando órbitas alrededor del Sol, tienen suficiente masa para que su gravedad supere las fuerzas del cuerpo rígido, de manera que asuman una forma en equilibrio hidrostático (prácticamente esférica) y han limpiado la vecindad de su órbita de planetesimales.
A Júpiter, Saturno, Urano y Neptuno los científicos los han denominado planetas gaseosos por contener en sus atmósferas gases como el helio, el hidrógeno y el metano, sin saber a ciencia cierta la estructura de su superficie.
[editar] Características principales de los planetas del Sistema Solar
| Planeta | Diámetro ecuatorial | Masa | Radio orbital (UA) | Periodo orbital (años) | Periodo de rotación (días) | Satélites naturales | Imagen |
|---|---|---|---|---|---|---|---|
| Mercurio | 0,382 | 0,06 | 0,38 | 0,241 | 58,6 | 0 |  |
| Venus | 0,949 | 0,82 | 0,72 | 0,615 | 243 | 0 |  |
| Tierra* | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1 |  |
| Marte | 0,53 | 0,11 | 1,52 | 1,88 | 1,03 | 2 |  |
| Júpiter | 11,2 | 318 | 5,20 | 11,86 | 0,414 | 63 |  |
| Saturno | 9,41 | 95 | 9,55 | 29,46 | 0,426 | 62 | |
| Urano | 3,98 | 14,6 | 19,22 | 84,01 | 0,718 | 27 |  |
| Neptuno | 3,81 | 17,2 | 30,06 | 164,79 | 0,6745 | 13 |
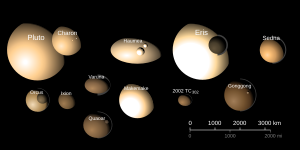
[editar] Planetas enanos
Poco después de su descubrimiento en 1930, Plutón fue clasificado como un planeta por la Unión Astronómica Internacional (UAI). Sin embargo, basándose en descubrimientos posteriores, se abrió un debate por algunos, con objeto de reconsiderar dicha decisión. Finalmente, el 24 de agosto de 2006 la UAI decidió que el número de planetas no se ampliase a 12, como se propuso en la reunión que mantuvieron sus miembros en Praga, sino que debía reducirse de 9 a 8. El gran perjudicado de este nuevo orden cósmico fue, nuevamente, el polémico Plutón, cuyo pequeño tamaño y su evolución dinámica en el Sistema Solar llevó a los miembros de la UAI a excluirlo definitivamente de su nueva definición de planeta.En dicha reunión de la UAI se creó una nueva clase de planeta, los planetas enanos, que a diferencia de los planetas, no han limpiado la vecindad de su órbita. Los cinco planetas enanos del Sistema Solar ordenados por proximidad al Sol son Ceres, Plutón, Haumea, Makemake y Eris.
[editar] Características principales de los planetas enanos del Sistema Solar
Los datos se expresan en relación a la Tierra.| Planeta enano | Diámetro medio | Diámetro Km | Masa | Radio orbital(UA) | Periodo orbital (años) | Periodo de rotación (días) | Satélites naturales | Imagen |
|---|---|---|---|---|---|---|---|---|
| Ceres | 0,074 | 952,4 | 0,00016 | 2,766 | 4,599 | 0,3781 | 0 |  |
| Plutón | 0,22 | 2302 | 0,82 | 39,482 | 247,92 | -6,3872 | 3 | |
| Haumea | 0,09 | 0,0007 | 43,335 | 285,4 | 0,167 | 2 | ||
| Makemake | 0,12 | 0,0007 | 45,792 | 309,9 | ? | 0 | ||
| Eris | 0,19 | 2398 | 0,0028 | 67,668 | 557 | ? | 1 |
[editar] Cuerpos menores del sistema solar
- Cinturón de asteroides (Véase también: Lista de asteroides).
- Objetos transneptunianos y cinturón de Kuiper (Véase también: Quaoar).
- Nube de Oort (Véase también: Cometa; Sedna).
Los mayores objetos transneptunianos son mucho mayores que los mayores asteroides. Los satélites naturales de los planetas mayores también tienen un amplio rango de tamaños y superficies, siendo los mayores de ellos mucho mayores que los asteroides mayores.
La siguiente tabla muestra las características más importantes de los principales cuerpos menores del Sistema Solar algunos de los cuales en un futuro podrían ser "ascendidos" al rango de planeta enano, como pasó con Makemake y Haumea. Todas las características se dan con respecto a la Tierra.
| Planetas menores | Diámetro ecuatorial | Masa | Radio orbital (UA) | Periodo orbital (años) | Periodo de rotación (días) | Imagen |
|---|---|---|---|---|---|---|
| (90482) Orcus | 0,066 - 0,148 | 0,000 10 - 0,001 17 | 39,47 | 248 | ? |  |
| (28978) Ixión | ~0,083 | 0,000 10 - 0,000 21 | 39,49 | 248 | ? | |
| (55636) 2002 TX300 | 0,0745 | ? | 43,102 | 283 | ? | |
| (20000) Varuna | 0,066 - 0,097 | 0,000 05 - 0,000 33 | 43,129 | 283 | 0,132 o 0,264 | |
| (50000) Quaoar | 0,078 - 0,106 | 0,000 17 - 0,000 44 | 43,376 | 285 | ? | |
| (90377) Sedna | 0,093 - 0,141 | 0,000 14 - 0,001 02 | 502,040 | 11500 | 20 |  |
[editar] Análisis y composición de los planetas del Sistema Solar
| Planetas internos | Planetas externos | |||||||
|---|---|---|---|---|---|---|---|---|
| Mercurio | Venus | Tierra | Marte | Júpiter | Saturno | Urano | Neptuno | |
| diámetro (km) | 4.878 | 12.100 | 12.756 | 6.787 | 142.984 | 120.536 | 51.108 | 49.538 |
| Distancia medías al sol (1UA= 149.600.000 km) | 0,39 UA | 0,72 UA | 1 UA | 1,52 UA | 5,2 UA | 9,54 UA | 19,19 UA | 30,06 UA |
| Periodo de rotacion | 58,6 días | 243 días | 23,9 horas | 24,6 horas | 9,8 horas | 10,6 horas | 17,2 horas | 16 horas |
| Periodo de revolución | 87,9 días | 224,7 días | 365,2 días | 686,9 días | 11,8 años | 29,4 años | 84 años | 164,8 años |
| Inclinación de órbita (en relación con la eclíptica) | 7,0° | 3,4° | 0,0° | 1,9° | 1,3° | 2,5° | 0,8° | 1,8° |
| Masa (en relación con la Tierra) | 0,056 | 0,82 | 1 (5,9 x 1024 kg) | 0,11 | 318 | 95 | 15 | 17 |
| Núm. de satélites conocidos | 0 | 0 | 1 | 2 | 17 | 22 | 21 | 8 |
| Composición de la atmósfera | Trazas de hidrógeno y helio | 96% CO2, 3% nitrógeno,0.1% agua | 78% nitrógeno, 21%oxigeno, 1% argón | 95% CO2, 1.6% argón, 3% nitrógeno | 90% hidrógeno, 10% helio, trazas de metano | 96% hidrógeno, 3% helio, 0.5% metano | 84% hidrógeno, 14% helio, 2% metano | 74% hidrógeno, 25% helio, 1% metano |
[editar] Formación y evolución del Sistema Solar

Concepción artística de un disco protoplanetario.
Véase también: Nebulosa protosolar
[editar] Investigación y exploración del Sistema Solar
Dada la perspectiva geocéntrica con la que es percibido el Sistema Solar por los humanos, su naturaleza y estructura fueron durante mucho tiempo desconocidos. Los movimientos aparentes de los objetos del Sistema Solar, observados desde la Tierra, se consideraban los movimientos reales de estos objetos alrededor de una Tierra estacionaria. Gran parte de los objetos del Sistema Solar no son observables sin la ayuda de instrumentos como el telescopio. Con la invención de éste comienza una era de descubrimientos (satélites galileanos; fases de Venus) en la que se abandona finalmente el sistema geocéntrico sustituyéndolo definitivamente por la visión copernicana del sistema heliocéntrico.En la actualidad el Sistema Solar es estudiado por telescopios terrestres, observatorios espaciales y misiones espaciales capaces de llegar hasta algunos de estos distantes mundos. Los cuerpos del Sistema Solar en los que se han posado sondas espaciales terrestres son Venus, la Luna, Marte, Júpiter y Titán. Todos los cuerpos mayores han sido visitados por misiones espaciales, incluyendo algunos cometas, como el Halley, y excluyendo Plutón.
La Cadena Alimenticia



Fig.1
Observa la Figura 1 : Relaciona, Compara y Marca la Respuesta Correcta.
1.-HAY MAYOR VARIEDAD DE VEGETALES EN EL:
a) DESIERTO b) VALLE c) PUNA d) ESTANQUE
2.-EN UNA AREA DETERMINADA DONDE HABITAN 1540 VICUÑAS, EN UN AÑO NACIERON 385 VICUÑAS Y MURIERON 77 ¿CUÁL ES EL PORCENTAJE DE NATALIDAD Y CUAL DE MORTALIDAD?
A- a) 34% b) 20% c) 25% d) 30%
B- a) 10% b) 3% c) 8% d) 5%
3.-EL OXIGENO ELEMENTO DEL AIRE SE ENCUENTRA EN MAYOR PORCENTAJE EN:
a) CHOSICA b) HUASCARAN c) PUCUSANA d) CUSCO
4.-EL CONDOR SE ALIMENTA DE:
a) AVES b) REPTILES c) PLANTAS d) ANIMALES MUERTOS
1.-HAY MAYOR VARIEDAD DE VEGETALES EN EL:
a) DESIERTO b) VALLE c) PUNA d) ESTANQUE
2.-EN UNA AREA DETERMINADA DONDE HABITAN 1540 VICUÑAS, EN UN AÑO NACIERON 385 VICUÑAS Y MURIERON 77 ¿CUÁL ES EL PORCENTAJE DE NATALIDAD Y CUAL DE MORTALIDAD?
A- a) 34% b) 20% c) 25% d) 30%
B- a) 10% b) 3% c) 8% d) 5%
3.-EL OXIGENO ELEMENTO DEL AIRE SE ENCUENTRA EN MAYOR PORCENTAJE EN:
a) CHOSICA b) HUASCARAN c) PUCUSANA d) CUSCO
4.-EL CONDOR SE ALIMENTA DE:
a) AVES b) REPTILES c) PLANTAS d) ANIMALES MUERTOS
I.-CADENA ALIMENTICIA:
En la naturaleza los seres vivos se encuentran íntimamente correlacionados en lo referente a la búsqueda de alimentos, protección y reproducción. En los animales existe competencia por el alimento y muchos deben cuidarse de no ser devorados. En cambio entre las plantas solo necesitan de agua, luz, suelo rico en minerales y aire. Es por eso que el equilibrio existente en el medio ambiente está en las relaciones alimenticias. Los alimentos pasan de un ser a otro en una serie de actividades reiteradas de comer y ser comido. Lo cual es en síntesis la cadena alimenticia que tiene como máximo cuatro o cinco eslabones.
El equilibrio natural es la interdependencia total de los seres vivos entre sí y con el medio que lo rodea. El hombre forma parte de este equilibrio y no puede independizarse del él. La cadena alimenticia es el continuo proceso del paso de alimentos de un ser a otro al comer y ser comido.
La base de la cadena es el mundo inorgánico constituido por: suelo, agua, aire y energía solar.
En la naturaleza los seres vivos se encuentran íntimamente correlacionados en lo referente a la búsqueda de alimentos, protección y reproducción. En los animales existe competencia por el alimento y muchos deben cuidarse de no ser devorados. En cambio entre las plantas solo necesitan de agua, luz, suelo rico en minerales y aire. Es por eso que el equilibrio existente en el medio ambiente está en las relaciones alimenticias. Los alimentos pasan de un ser a otro en una serie de actividades reiteradas de comer y ser comido. Lo cual es en síntesis la cadena alimenticia que tiene como máximo cuatro o cinco eslabones.
El equilibrio natural es la interdependencia total de los seres vivos entre sí y con el medio que lo rodea. El hombre forma parte de este equilibrio y no puede independizarse del él. La cadena alimenticia es el continuo proceso del paso de alimentos de un ser a otro al comer y ser comido.
La base de la cadena es el mundo inorgánico constituido por: suelo, agua, aire y energía solar.
II.- ESLABONES DE LA CADENA ALIMENTICIA. (Fig.1)
Primer Eslabón .- Lo constituyen las plantas verdes que producen alimentos mediante la fotosíntesis, por producir los alimentos que pasarán luego a través de toda cadena, las plantas reciben el nombre de PRODUCTORES.
Segundo Eslabón.-Lo constituyen los animales herbívoros llamados consumidores de primer orden. Estos dependen de los productores por que se alimentan de plantas, toman la energía solar acumulada en forma de celulosa, azúcar, almidón, etc. Para poder vivir entre los herbívoros tenemos: los ratones, la vicuña, la taruca, los venados, muchos peces, aves (arroceros, palomas, fruteros etc.)
Tercer Eslabón.- Lo conforman los Carnívoros, llamados consumidores de segundo orden, que utilizan a los herbívoros como alimento, obteniendo la energía solar de tercera mano. Entre los carnívoros están: los lobos marinos, el puma, el zorro, la boa, el bonito. Cualquier animal que consume carne es un carnívoro, aún los más pequeños como la libélula, la araña y el alacrán. Los carnívoros reciben también el nombre de depredadores y los animales de los que se alimentan se denominan su presa. El puma es depredador de venados y vicuñas que son sus presas.
Cuarto Eslabón.- Lo conforman los Carroñeros también se les consideran Consumidores de tercer orden que se alimentan de animales muertos y el de los carnívoros que se alimentan de otros carnívoros así el gallinazo y el cóndor son carroñeros. El puma se puede alimentar de herbívoros pero también puede cazar zorros; alimentándose en éste caso de un carnívoro, el zorro puede alimentarse de herbívoros (ratones) o de carnívoros (culebras y lagartijas) otros seres como el hombre, el cerdo, sajino se alimentan de plantas y carnes a estos se les denomina Omnívoros .Esta relación de dependencia mutua entre las plantas y los animales se puede representar en forma de una Pirámide, la base es el mundo inorgánico. (Fig. 2)
Organismos Desintegradores o Descomponedores.- Lo constituyen los Saprofitos (hongos y bacterias) encargados de sintetizar las sustancias orgánicas muertas de origen vegetal o animal. Absorben ciertos productos y liberan el resto que se incorporan al medio abiótico para ser tomado por los organismos productores. Ejemplo así el fitoplancton (productor) mediante la fotosíntesis transforma la energía radiante de la luz solar en energía química, estos sirven de alimento al zooplancton (consumidor de primer orden) que a su vez es devorado por la anchoveta (consumidor de tercer orden) al morir dichas aves, los organismos desintegradores regresan al mar los elementos necesarios que han de servir como nutrimento al fitoplancton.
Segundo Eslabón.-Lo constituyen los animales herbívoros llamados consumidores de primer orden. Estos dependen de los productores por que se alimentan de plantas, toman la energía solar acumulada en forma de celulosa, azúcar, almidón, etc. Para poder vivir entre los herbívoros tenemos: los ratones, la vicuña, la taruca, los venados, muchos peces, aves (arroceros, palomas, fruteros etc.)
Tercer Eslabón.- Lo conforman los Carnívoros, llamados consumidores de segundo orden, que utilizan a los herbívoros como alimento, obteniendo la energía solar de tercera mano. Entre los carnívoros están: los lobos marinos, el puma, el zorro, la boa, el bonito. Cualquier animal que consume carne es un carnívoro, aún los más pequeños como la libélula, la araña y el alacrán. Los carnívoros reciben también el nombre de depredadores y los animales de los que se alimentan se denominan su presa. El puma es depredador de venados y vicuñas que son sus presas.
Cuarto Eslabón.- Lo conforman los Carroñeros también se les consideran Consumidores de tercer orden que se alimentan de animales muertos y el de los carnívoros que se alimentan de otros carnívoros así el gallinazo y el cóndor son carroñeros. El puma se puede alimentar de herbívoros pero también puede cazar zorros; alimentándose en éste caso de un carnívoro, el zorro puede alimentarse de herbívoros (ratones) o de carnívoros (culebras y lagartijas) otros seres como el hombre, el cerdo, sajino se alimentan de plantas y carnes a estos se les denomina Omnívoros .Esta relación de dependencia mutua entre las plantas y los animales se puede representar en forma de una Pirámide, la base es el mundo inorgánico. (Fig. 2)
Organismos Desintegradores o Descomponedores.- Lo constituyen los Saprofitos (hongos y bacterias) encargados de sintetizar las sustancias orgánicas muertas de origen vegetal o animal. Absorben ciertos productos y liberan el resto que se incorporan al medio abiótico para ser tomado por los organismos productores. Ejemplo así el fitoplancton (productor) mediante la fotosíntesis transforma la energía radiante de la luz solar en energía química, estos sirven de alimento al zooplancton (consumidor de primer orden) que a su vez es devorado por la anchoveta (consumidor de tercer orden) al morir dichas aves, los organismos desintegradores regresan al mar los elementos necesarios que han de servir como nutrimento al fitoplancton.
Pirámide Alimenticia.

(Fig. 2)
Observa el dibujo 2, Relaciona, Compara y Marca la Respuesta Correcta.
l.- LAS NUBES SE FORMAN POR EL FENÓMENO DE:
a) CONDENSACIÓN b) SUBLIMACIÓN c) EVAPORACIÓN d) LICUACIÓN
2.- QUE UNIDAD UTILIZARÍAS PARA MEDIR LOS CAMPOS DE CULTIVO:
a) METRO CÚBICO b)METRO LINEAL c) YARDAS d) METRO CUADRADO
3.-LOS ANIMALES QUE SE DESPLAZAN A GRANDES DISTANCIAS EN BUSCA DE SUS ALIMENTOS SON:
a) CÓNDORES b) PUMAS c) VICUÑAS d) BOAS
4.- EN LAS ALTURAS EL ELEMENTO DEL AIRE QUE SE ENCUENTRA MUY ENRARECIDO ES EL:
a) NITRÓGENO b) OXIGENO c) CARBONO d)HIDRÓGENO
l.- LAS NUBES SE FORMAN POR EL FENÓMENO DE:
a) CONDENSACIÓN b) SUBLIMACIÓN c) EVAPORACIÓN d) LICUACIÓN
2.- QUE UNIDAD UTILIZARÍAS PARA MEDIR LOS CAMPOS DE CULTIVO:
a) METRO CÚBICO b)METRO LINEAL c) YARDAS d) METRO CUADRADO
3.-LOS ANIMALES QUE SE DESPLAZAN A GRANDES DISTANCIAS EN BUSCA DE SUS ALIMENTOS SON:
a) CÓNDORES b) PUMAS c) VICUÑAS d) BOAS
4.- EN LAS ALTURAS EL ELEMENTO DEL AIRE QUE SE ENCUENTRA MUY ENRARECIDO ES EL:
a) NITRÓGENO b) OXIGENO c) CARBONO d)HIDRÓGENO
III.- EL NEXO ALIMENTICIO.- Las cadenas alimenticias no son series aisladas sino que están conectadas entre sí. Veamos un ejemplo, una cadena simple sería lo siguiente.
Hierba -> Ratón -> Zorro -> Gallinazo.
Sin embargo el ratón no se alimenta de una sola planta, ni el zorro solo de ratones, tampoco la planta solo es comido por ratones sino también por orugas de mariposas, vicuñas, tarucas, guanacos, alpacas, vacas, caballos etc. etc. Al conectar todas esos datos entre sí ya no obtenemos una cadena, sino una red alimenticia o nexo alimenticio.
Hierba -> Ratón -> Zorro -> Gallinazo.
Sin embargo el ratón no se alimenta de una sola planta, ni el zorro solo de ratones, tampoco la planta solo es comido por ratones sino también por orugas de mariposas, vicuñas, tarucas, guanacos, alpacas, vacas, caballos etc. etc. Al conectar todas esos datos entre sí ya no obtenemos una cadena, sino una red alimenticia o nexo alimenticio.
III.- EL NEXO ALIMENTICIO.- Las cadenas alimenticias no son series aisladas sino que están conectadas entre sí. Veamos un ejemplo, una cadena simple sería lo siguiente.
Hierba -> Ratón -> Zorro -> Gallinazo.
Hierba -> Ratón -> Zorro -> Gallinazo.
Sin embargo el ratón no se alimenta de una sola planta, ni el zorro solo de ratones, tampoco la planta solo es comido por ratones sino también por orugas de mariposas, vicuñas, tarucas, guanacos, alpacas, vacas, caballos etc. etc. Al conectar todas esos datos entre sí ya no obtenemos una cadena, sino una red alimenticia o nexo alimenticio.
IV.-LA ENERGÍA EN LA CADENA ALIMENTICIA.- En cada traspaso de los alimentos de un eslabón a otro de la cadena, se pierde una gran proporción de energía (80 a 90%) en forma de calor. Por lo tanto el número de eslabones es limitado, cuando más corta es la cadena de alimentos; es decir cuanto más cerca está el organismo del principio de la cadena, tanto mayor es la energía disponible; existe un continuo fluir de energía capturada por las plantas hacia los consumidores del primer y segundo orden, se establece así una relación de dependencia entre las plantas, los animales.
La energía radiante del sol capturada por las planteas con clorofila y transformada en energía química de alimento es tomada por los animales herbívoros y éstos sirven de presa a los depredadores o carnívoros y éstos a otros depredadores. Al morir sus restos alimentan a los carroñeros y finalmente los organismos desintegradores descomponen las moléculas orgánicas, se alimentan de una parte y liberan el resto al medio ambiente. En cada uno de estos niveles el flujo de energía de un organismo a otro es cada vez menor por que se pierde durante la respiración y en forma de calor. Este flujo se realiza en un solo sentido. Este flujo de energía debe existir un equilibrio entre los organismos productores y consumidores por ejemplo sí aumentan los carnívoros destruyen a los herbívoros lo que puede ocasionar la muerte de los carnívoros por falta de alimentos. Si por el contrario se destruye a los carnívoros, los animales herbívoros aumentan pero destruyen la vegetación, lo que también puede ocasionar su muerte.
La energía radiante del sol capturada por las planteas con clorofila y transformada en energía química de alimento es tomada por los animales herbívoros y éstos sirven de presa a los depredadores o carnívoros y éstos a otros depredadores. Al morir sus restos alimentan a los carroñeros y finalmente los organismos desintegradores descomponen las moléculas orgánicas, se alimentan de una parte y liberan el resto al medio ambiente. En cada uno de estos niveles el flujo de energía de un organismo a otro es cada vez menor por que se pierde durante la respiración y en forma de calor. Este flujo se realiza en un solo sentido. Este flujo de energía debe existir un equilibrio entre los organismos productores y consumidores por ejemplo sí aumentan los carnívoros destruyen a los herbívoros lo que puede ocasionar la muerte de los carnívoros por falta de alimentos. Si por el contrario se destruye a los carnívoros, los animales herbívoros aumentan pero destruyen la vegetación, lo que también puede ocasionar su muerte.







No hay comentarios:
Publicar un comentario